Soluciones Empíricas y Valoradas
SOLUCIONES EMPÍRICAS
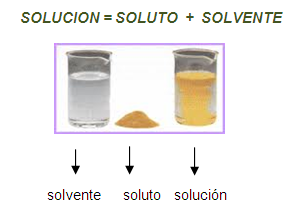 |
| Imagen 1: Ejemplificación de una solución. |
Una solución,
en química, es una mezcla homogénea de dos o más sustancias en
cantidades relativas que se pueden variar continuamente hasta lo que se
llama el límite de solubilidad.
Una solución empírica es
aquella solución que no posee una concentración determinada, siendo
distinta a las soluciones valoradas, a las cuales si se les conoce la
concentración exacta en términos de molaridad, normalidad, molaridad,
osmolaridad y concentraciones porcentuales.
Tipos de soluciones empíricas:
Las soluciones
empíricas se clasifican atendiendo la mayor o menor cantidad de soluto
presente, pero sin ser necesario expresar con exactitud su cantidad.
También llamadas disoluciones
cualitativas, esta clasificación no toma en cuenta la cantidad numérica de
soluto y disolvente presentes, y dependiendo de la proporción entre ellos se
clasifican de la siguiente manera:
Diluidas
solvente.
 |
| Imagen 2: Ilustración de solución diluida. |
- Concentradas
 |
| Imagen 3: Ilustración de solución concentrada. |
La cantidad de soluto que se encuentra en el solvente es la máxima que se puede disolver a temperatura constante. Cuando el solvente ya no puede disolver más soluto, entonces la solución esta saturada.
 |
| Imagen 4: Ilustración de solución saturada. |
 |
| Imagen 5: Ilustración de solución sobresaturada. |
Cuando
se agrega azúcar al café se tiene un ejemplo de solución empírica.
Ciertamente uno puede agregar un número cuantitativo de cucharadas para
determinar la concentración pero esto carece de valor analítico puesto
que la concentración no es exacta.
Términos como “una
cucharada” o “una pizca” son términos empíricos puesto que no expresan
concentración en función a la masa exacta, o al número de moles o
equivalentes químicos que hay en solución.
SOLUCIONES VALORADAS
Las soluciones valoradas o
soluciones estándar son aquellas en las que las medidas de
concentración de sus componentes son conocidas y seguidas con precisión.
Las medidas de concentración están estandarizadas.
Para
realizar una solución valorada se deben pesar o medir cada uno de los
componentes de la solución y asegurarse de que ni un miligramo de soluto
o de solvente quede adherido en alguno de los instrumentos de medición.
Este tipo de clasificación es muy utilizada en el campo de la
ciencia y la tecnología, pues en ellas es muy importante una alta precisión. Existen tres
tipos de disoluciones valoradas:
Tipos de soluciones valoradas:
Soluciones valoradas iónicas
Son aquellas en las
que los componentes de la solución (el soluto y el solvente) forman
enlaces iónicos. Esto quiere decir que se presentan dos o más iones
enlazados.
De estos iones, uno tiene carga positiva (se denomina catión) y el otro tiene carga negativa (se denomina anión).
Este tipo de soluciones se emplea para el análisis de aniones como el cloruro (Cl -) y el sulfato (SO4 2-). Asimismo, se emplea en el análisis de cationes como el sodio (Na +) y el potasio (K +).
Soluciones valoradas elementales
Estas soluciones están formadas por elementos en estado puro y se obtienen a partir de disoluciones de otros compuestos.
Soluciones valoradas formuladas
Estas soluciones se basan en el cálculo del peso atómico y el número de elementos presentes en la solución.
*Unidades:
- Unidades Físicas.-
%en peso= peso de soluto/peso de solución*100
%en volumen= volumen de soluto / Volumen de solución * 100
%en peso-volumen= peso de soluto/volumen de solución *100
- Unidades químicas.-
Molaridad= Numero de soluto/volumen de solución; moles de soluto= g/P.M.
Normalidad= Numero de pesos equivalentes/volumen de solución
# Pesos equivalentes= Gramos de soluto/peso equivalente
BIBLIOGRAFÍA:
- Helmenstine, A.(2017). Solution Definition.
- Recuperado de: thoughtco.com. (10/10/2018).
- Saturated Solutions and Solubility, (2017). Soluciones saturadas y solubilidad.
- Recuperado de: chem.libretexts.org (10/10/2018).
- Solutions,S.(2013).Soluciones.
- Recuperado de: sparknotes.com. (10/10/2018).
- Standard solutions,SF(2013)Soluciones Valoradas.
- Recuperado de: study.com (10/10/2018).
- Martinez,H. (2017) Que son las soluciones valoradas.
- Recuperado de: https://www.lifeder.com/soluciones-valoradas/ (10/10/2018).
- Carvajal, A. (2014) Soluciones valoradas.
- Recuperado de: http://solucionvalorada.blogspot.mx (10/10/2018).
- EcuRed. (2014). soluciones.
- Recuperado de: https://www.ecured.cu/Soluci%C3%B3n_(Qu%C3%ADmica)(10/10/2018).
INTEGRANTES:
-Fuentes Rosas Irán Valeria-Durán Morales Filiberto
-Trujillo Aguilar Miguel Ángel
-Maldonado Camargo Abraham Josafat
-González Ziania Yatziri
Comentarios
Publicar un comentario